Gründung von Alexion in New Haven, CT.

Börsengang unter ALXN.

Soliris (Eculizumab) wird erstmals zugelassen für die Behandlung von Patient:innen mit PNH.

Soliris wird erstmals zugelassen für die Behandlung von Patient:innen mit aHUS.

Akquisition von Asfotase alfa, der ersten möglichen Behandlung von Menschen mit HPP.

Akquisition von Synageva und seines Moleküls Sebelipase alfa, zur potenziellen Behandlung von Menschen mit LAL-D.

Strensiq (Asfotase alfa) wird erstmals zugelassen für die Behandlung von Patient:innen mit HPP.
Kanuma (Sebelipase alfa) wird erstmals zugelassen für die Behandlung von Patient:innen mit LAL-D.

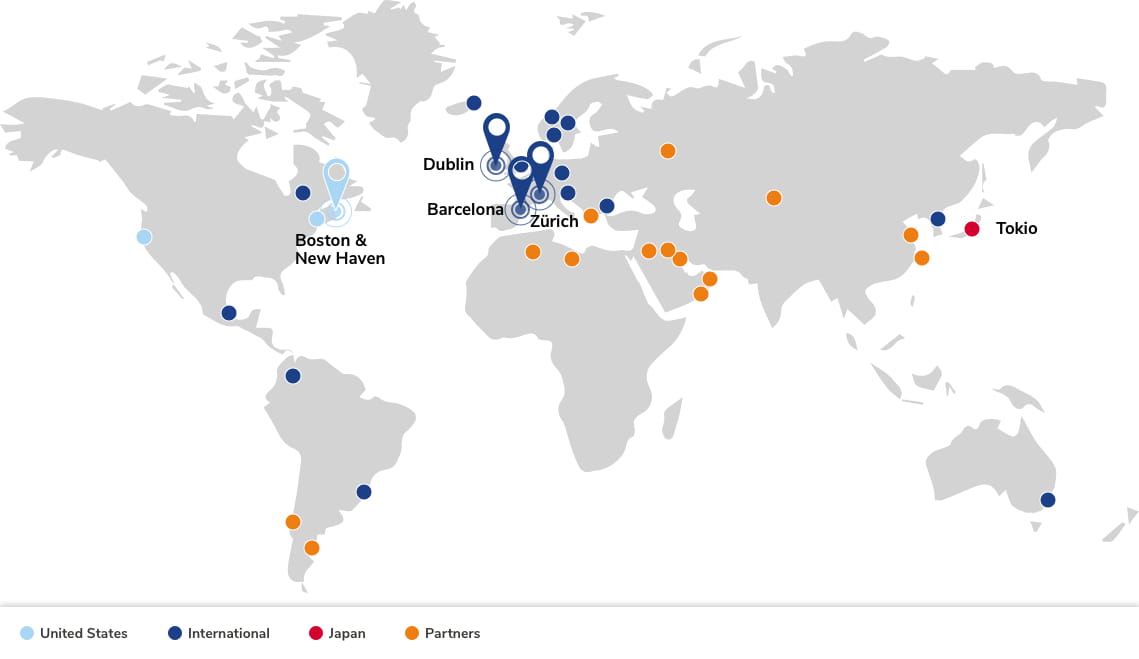
Eröffnung des Forschungs- und Entwicklungszentrums in New Haven.

Soliris wird erstmals zugelassen
für die Behandlung von Patient:innen mit gMG.

Partnerschaft mit Halozyme Therapeutics und Etablierung eines Lizenzvertrags für ENHANZE, einer Medikamentenverabreichungstechnologie.

Eröffnung des Hauptsitzes in Boston.

Akquisition von Syntimmune, dem Unternehmen, das ALXN1830 (SYNT001)
entwickelt hat, einen antineonatalen Fc-Rezeptor (FcRn)-Antikörper zur
Behandlung von seltenen, durch Immunglobulin G (IgG)-vermittelte
Krankheiten.

Partnerschaft mit Complement Pharma und Dicerna.

Ultomiris (Ravulizumab) wird erstmals zugelassen zur Behandlung von erwachsenen Patient:innen mit PNH.

Partnerschaft mit Caelum Biosciences und Zealand Pharma 2019.
Ankündigung eines Lizenzvertrages für Japan mit Eidos (BridgeBio) zur Entwicklung und Kommerzialisierung von acoramidis (ALXN2060) in Japan zur Behandlung von Patient:innen mit Amyloidose (ATTR-CM).

Soliris wird erstmals zugelassen zur Behandlung von Patient:innen mit NMOSD.
Ultomiris wird erstmals zugelassen für Patient:innen mit aHUS.

Akquisition von Achillion, dem Unternehmen, das sich auf die Entwicklung von oralen niedermolekularen Faktor-D-Hemmern zur Behandlung seltener Erkrankungen konzentriert, die durch Komplement-Alternativwege vermittelt werden.

Alexion wird von AstraZeneca übernommen und wird Alexion, AstraZeneca Rare Disease.
![]()
![]()
![]()
![]()

Ultomiris wird erstmals zugelassen für die Behandlung von pädiatrischen Patient:innen mit PNH.![]()
![]()
![]()
Koselugo (Selumetinib) wird erstmals zugelassen für die Behandlung von pädiatrischen Patient:innen mit NF1.

Ultomiris wird erstmals zugelassen für die Behandlung von erwachsenen Patient:innen mit gMG.

Eröffnung des Forschungs- und Entwicklungszentrums in Barcelona.

Ultomiris wird erstmals zugelassen für die Behandlung von erwachsenen Patient:innen mit NMOSD.
Soliris wird erstmals zugelassen für die Behandlung von pädiatrischen Patient:innen mit gMG.

Voydeya (Danicopan) wird erstmals zugelassen als Add-on-Therapie zu Ravulizumab oder Eculizumab bei Erwachsenen mit PNH und residueller hämolytischer Anämie.