Kurz zusammengefasst:
NF1 wird meist schon im Kindesalter anhand klinischer Kriterien erkannt. Zwei typische Merkmale (z. B. Café-au-lait-Flecken, Neurofibrome oder eine pathogene NF1-Variante) sichern die Diagnose; bei Kindern betroffener Eltern genügt eins.
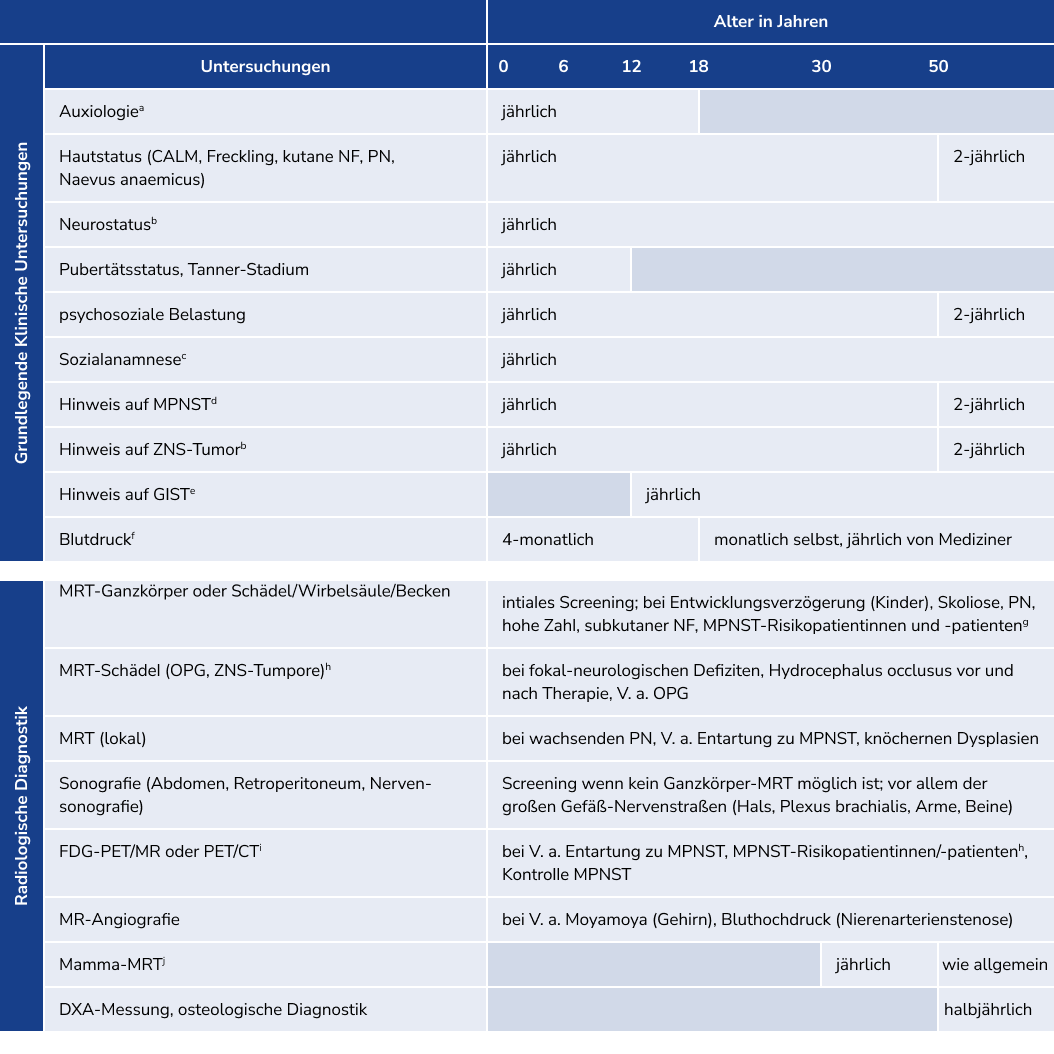
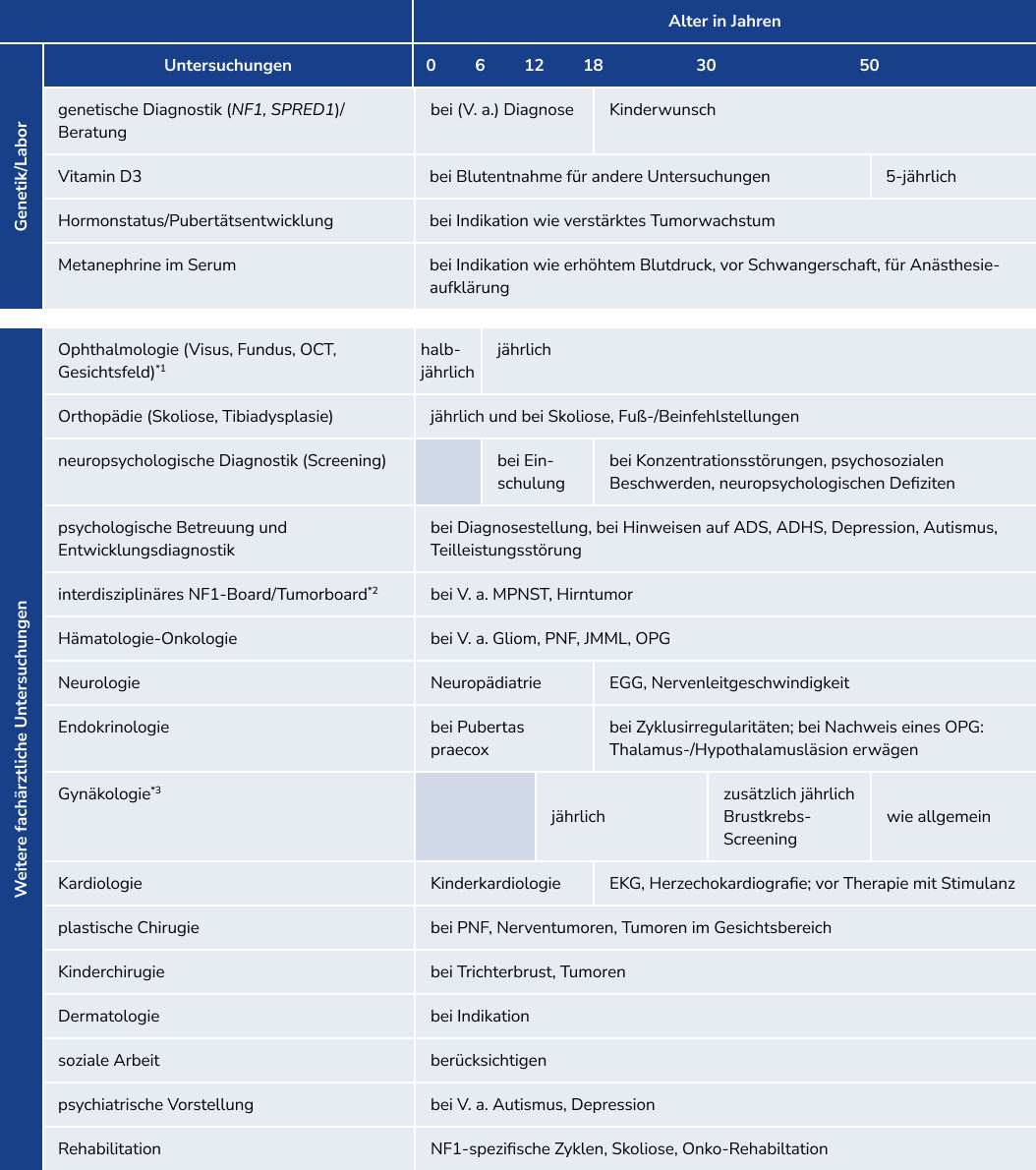
Da sich viele Manifestationen altersabhängig entwickeln, sind eine frühe Diagnosestellung und interdisziplinäre Betreuung mit relativ engmaschigen, an das Lebensalter angepassten Untersuchungsintervallen entscheidend.
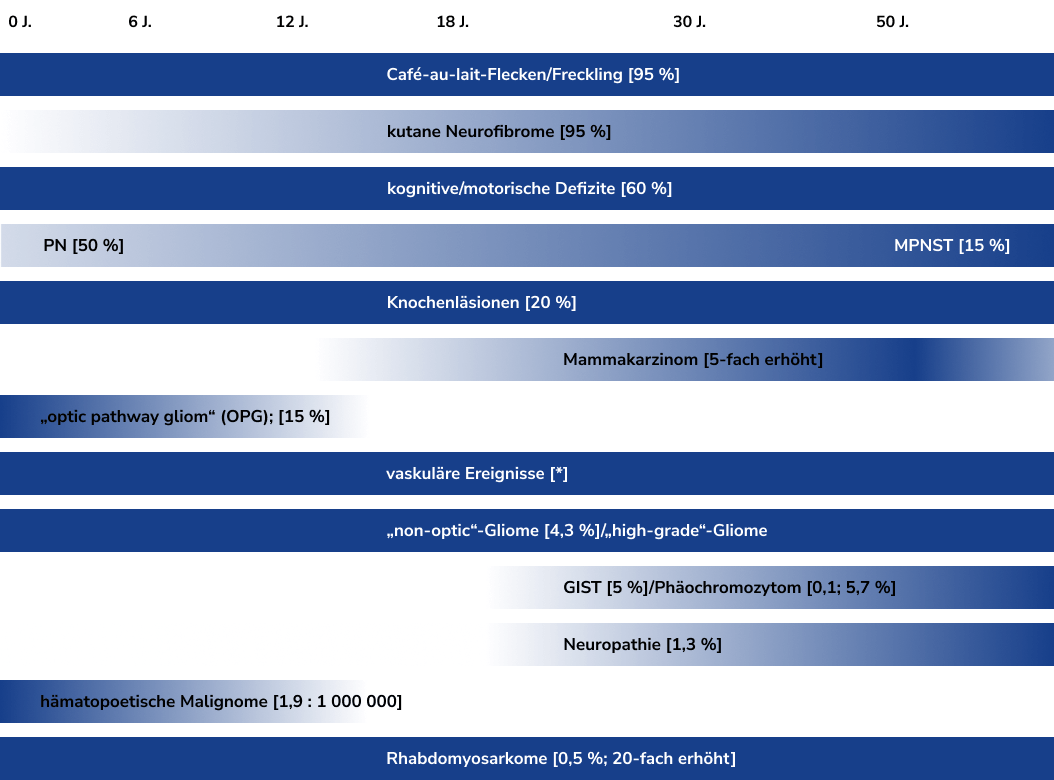
Neurofibromatose Typ 1 (NF1) ist mit kutanen, neurologischen, orthopädischen und neoplastischen Manifestationen verbunden, die teilweise progredient verlaufen und zu erheblicher Morbidität führen können.ref_Bergqvist_2020 Da NF1 derzeit nicht heilbar ist, kommt der Früherkennung möglicher medizinischer, neuropsychologischer und psychosozialer Probleme eine besondere Bedeutung zu. Ziel der multidisziplinären Betreuung ist es, durch frühzeitige Intervention die Krankheitslast zu reduzieren.ref_Hendrich_2023
Die Diagnose erfolgt in der Regel klinisch, basierend auf einer körperlichen Untersuchung und Familienanamnese. Nach den revidierten internationalen Konsensempfehlungen (Legius et al., 2021ref_Legius_2021) gilt NF1 als gesichert, wenn mindestens zwei der folgenden Merkmale erfüllt sind; bei einem Kind eines betroffenen Elternteils, genügt bereits ein Merkmal.ref_Hartung_2025